多吉美專題 >> 多吉美的臨床藥代動力學研究
多吉美的臨床藥代動力學研究
- 來源: 百濟新特藥房網 發布時間:2007-3-13 14:46:00
概述
此部分內容目的是提供對Sorafenib臨床藥理研究方案的總結。此節中提到的研究包括為確定用藥劑量而進行的劑量遞增型研究,生物藥劑學研究,代謝途徑的研究,對特殊人群的研究以及為評價Sorafenib與其他已上市的抗癌藥物聯用時的藥效學及安全性研究,以上研究結果已于2004年12月31日報道。此節還增加了在日本進行的劑量遞增型研究11497所得到的藥代動力學資料(于2005年4月22日報道)。
在癌癥患者中進行的I期研究目的是尋找適合的給藥方案,以達到最長的給藥間隔而不影響藥物濃度,因此對多種給藥方案進行了觀察。從這些I期研究中得出的安全性和藥代動力學以及藥物抗癌效果的資料促使在后來開展的臨床II期研究中采用400mg每日兩次的連續給藥方案。
Sorafenib的藥代動力學結果顯示暴露量在患者間存在較高差異,變異系數百分比(%CV)范圍從36%到91%。與單劑量相比,口服400mg每日兩次的穩態Cmax和 AUC(0-12)均值分別增加了4倍和4.7倍。與單劑量相比,口服400mg每日兩次的穩態Cmax和 AUC(0-12)均值分別增加了4倍和4.7倍。進食高脂肪飲食后Sorafenib的吸收降低了約29%。因此,在服用Sorafenib時,應進食中等脂肪飲食或者禁食。Sorafenib與阿霉素聯合用藥,阿霉素在HCC患者的AUC均值增加了21%。尚不清楚這種相互作用是否具有臨床相關性。
Sorafenib與依立替康聯合用藥,依立替康的活性代謝產物SN-38的暴露量顯著增加(67%到120%),SN-38經由UGT1A1進行代謝。這種相互作用的臨床相關性未明。
藥物吸收
Sorafenib的藥代動力學研究采用的方案包括健康研究者單次給藥和癌癥患者每日兩次給藥。在健康志愿者與中等量脂肪餐一起單次服用400mg后,Sorafenib吸收較快,中位達峰濃度時間tmax約4-8小時,平均最大濃度Cmax范圍1.67-2.13mg/L。血漿濃度-時間資料顯示出1-2個tmax后的再吸收峰,意味著其肝內再循環。穩態藥代動力學對癌癥患者服用Sorafenib片劑400mg每日兩次后進行多點分析(研究100342、100277和10164的血漿藥代動力學樣本在第一療程最后一次給藥后收集)。Sorafenib的中位吸收時間tmax,ss為3小時(范圍0.0-24小時),tmax后再吸收峰出現于給藥后8-12小時或/和24小時。歐洲和北美進行的I期研究中患者平均穩態下Cmax,ss、AUC(0-12),SS值分別為7.7mg/L和64.3mg*hr/L。(見表5-7)
表 5-7:在試驗10164、100277、100283和100342中,癌癥患者口服給藥,每日兩次,每次服用400mg Sorafenib后,血漿中Sorafenib及其代謝產物的穩態Cmax和 AUC(0-12)參數(幾何平均值,%CV)
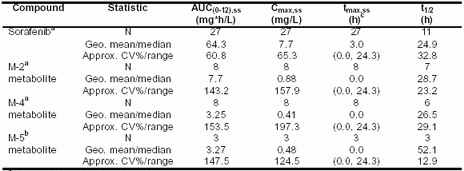

a 給藥至少7天后的穩態數據
b 給藥至少21天后的穩態數據
c tmax的平均值及范圍
t1/2 半衰期,與血藥濃度-時間曲線的末端斜率有關
Sorafenib的藥代動力學結果顯示暴露量在患者間存在較高差異,變異系數百分比(%CV)范圍從36%到91%。
多劑量蓄積
I期臨床試驗評價了多劑量給藥后Sorafenib在血液中的蓄積。雖然患者間存在相當大的差異,但是與預計的單一Sorafenib的終末端消除半衰期均值約為25到48小時的結果相符。比較試驗10164中患者7天和21天的暴露量數據,發現給藥7天之后Sorafenib的暴露量不再增加,因此Sorafenib的暴露量在給藥后7天之內就達到了穩態。與單劑量相比,口服400mg每日兩次的穩態Cmax和 AUC(0-12)均值分別增加了4倍和4.7倍。
相對生物利用度
通過與含有PEG和吐溫-80的溶液劑對比,評價50mg Sorafenib片劑的相對生物利用度。與溶液劑相比,與單劑量相比,口服400mg每日兩次的穩態Cmax和 AUC(0-12)均值分別增加了4倍和4.7倍。
膳食的影響
為了研究膳食的影響,分別評價了健康志愿者服用單劑量Sorafenib,同時進食高脂肪飲食、中等脂肪飲食或禁食狀態下的藥代動力學。進食中等脂肪飲食后Sorafenib片劑的生物利用度與禁食情況相似。與禁食相比,進食高脂肪飲食后Sorafenib的吸收降低了約29%。因此,在服用Sorafenib時,應進食中等脂肪飲食或者禁食。
每日一次與每日兩次
分別評價了Sorafenib以兩種方式給藥的藥代動力學:單劑量200mg(QD)和100mg每日兩次(bid)。在服用100mg bid的患者,24小時內AUC值比200mg QD患者高兩倍。每日兩次給藥后生物利用度增加,可能歸因于Sorafenib在水中的低溶解度,導致胃腸道下游部分的吸收減少。因為在每日一次情況下,隨著給藥劑量的增加,生物利用度達到明顯的穩態水平,所以我們選用每日兩次的給藥方式以達到最佳吸收或提高吸收程度。
劑量比例關系
在低于400mg bid劑量,AUC隨劑量提高而上升,通常與劑量有關且與劑量成正比例關系。但是在600mg bid劑量AUC(0-12),ss均值與400mg bid相比并未成比例增加,在800mg bid劑量AUC(0-12),ss均值與600mg bid相比也未成比例增加。
分布
99.5%的Sorafenib與血漿蛋白結合,結合程度與濃度呈線性相關。Sorafenib在紅血球和血漿中的分布大致相等,血漿與血液之比為1.33。
消除
為研究Sorafenib的排泄和代謝途徑(試驗11195),在四位健康志愿者進行了體內質量平衡試驗。口服單劑量[14C] Sorafenib后,放射活性檢測發現Sorafenib主要經糞便排泄,約占放射活性總量的77%,尿液中占19%。原藥是糞便提取物中的主要成分(給藥劑量的50.7%),其次是M-6,羧酸化衍生物,占給藥劑量的19%。經尿液排泄的19%中,主要成分(14.8%)是Sorafenib葡糖苷酸(M-7),和2.7%的M-2葡糖苷酸—M-8,尿液中未見Sorafenib原藥。血漿放射活性總量中,73%以Sorafenib形式進入血液循環,17%為代謝產物M-2,二者藥理學活性相似。血漿中其他放射活性代謝產物均低于1%。
活性代謝產物的藥代動力學
I 期和II期臨床試驗研究了Sorafenib的代謝產物M-2、M-4和M-5在癌癥患者體內的藥代動力學(圖5-1)。這些數據表明在400mg bid劑量,多劑量給藥后M-2的暴露量約占總暴露量(原藥和代謝產物總和)的16%。代謝產物M-2和M-4在給藥后7天達到穩態。穩態時代謝產物M-4占總暴露量的8%,M-5占6%。比較代謝產物M-5在給藥后第1天和第21天的AUC和Cmax值,發現第21天M-5暴露量的增加高于Sorafenib和M-2(圖5-1)。
體內代謝
已完成Sorafenib在大鼠(73),犬(74)和人(63)體內的生物轉化試驗,結果如表4-5所示。到目前為止,口服單劑量藥物后,原藥是大鼠,犬和人血漿中的主要組分(在放射活性AUC總量中占71%-73%)。與人相比,大鼠和犬血漿中M-3(BAY 72-1973)居優勢地位,分別占放射活性AUC總量的12.1%和15.6%。在人血漿中M-2(BAY 67-3472, N-氧化產物)是主要的代謝產物(AUC總量的16.7%),但僅在大鼠血漿中檢測到少量M-2(0.9%),在犬血漿中則未檢出。
表4-5:體內生物轉化:口服單劑量[14C]標記的BAY54-9085后,大鼠(PH-33292),犬(PH-33063)和人(PH-33427)血漿中的主要組分


a 以[14C]Sorafenib的自由堿基計
AUC 血藥濃度時間曲線下面積
在人體,Sorafenib的血藥濃度時間曲線出現幾個次級峰,表明存在肝腸循環,肝腸循環的出現歸因于下述兩種過程:
· 藥物的葡糖苷酸化產物M-7經膽管分泌到腸,葡糖苷酸產物分解,隨后Sorafenib在腸內再吸收。
· 藥物的氧化產物M-2經膽管分泌到腸,經結腸菌還原為Sorafenib,隨后Sorafenib在腸內再吸收。
僅在人體觀察到兩種重要的生物轉化途徑,在大鼠和犬則未發現肝腸循環。大鼠和犬口服[14C]標記的Sorafenib甲苯磺酸鹽后,放射活性幾乎全部經糞便排泄。在人體約75%的給藥劑量經糞便排泄。原藥是人(給藥劑量的50.7%)和大鼠(32.3%)糞便提取物中的主要組分,但在犬僅占給藥劑量的3.5%。在人,大鼠和犬的糞便提取物中,羧酸化產物M-6分別占放射活性總量的19.1%,30.0%和62.6%。羥甲基化產物M-3(BAY 72-1973)幾乎是動物體內獨有的代謝產物,在大鼠和犬的糞便中分別為23.0%和15.0%。
在人體,經腎臟的排泄比大鼠或犬更為明顯。在人的尿液(劑量的19%)中檢測到兩種代謝產物:M-7,Sorafenib的葡糖苷酸化產物(劑量的14.8%);M-8,M-2的葡糖苷酸化產物(劑量的2.7%)。尿中未發現原藥成分。比較Sorafenib在人體和動物的生物轉化發現,兩條代謝途徑在體外和體內存在顯著差異。在人體,吡啶的N-氧化反應(M-2, BAY 67-3472)比甲基羥基化反應(M-3, BAY 72-1973)更為顯著。Sorafenib的葡糖苷酸化僅在人體內具有重要意義。
綜上所述,在人體Sorafenib經兩條途徑進行生物轉化,由CYP3A4催化的M-2的生成以及經由葡糖醛酸轉移酶UGT1A9催化的葡糖苷酸化產物M-7的生成。此外,在人腎臟也能生成葡糖苷酸化產物M-7。由于存在兩條生物轉化途徑,一般認為Sorafenib與CYP3A4抑制劑不太可能發生藥物間相互作用。在臨床試驗中,CYP3A4的強效抑制劑酮康唑與BAY54-9085聯合用藥,對Sorafenib的血藥濃度并未產生任何顯著影響,最可能的原因是葡糖苷酸化代謝途徑發揮了作用(75)。
圖 5-1:在給藥21天/停藥7天的試驗(試驗10164)中,癌癥患者服用600 mg bid劑量的Sorafenib后第1、7、21天,Sorafenib及其代謝產物M-2,M-4和M-5的血藥濃度
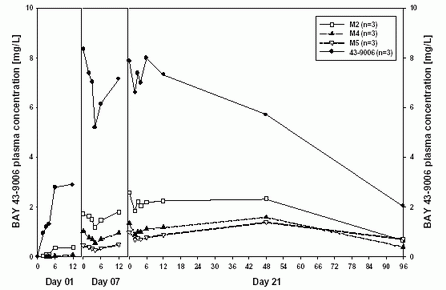 上述結果與代謝產物M-5的半衰期較長一致。日本癌癥患者在第14天和第28天的數據表明,給藥14天后代謝產物M-5達到穩態。假設Sorafenib及其三種代謝產物(M-2、M-4、M-5)有相似的體外藥理學活性,而且各占人血漿中所有藥物有關物質AUC總量的30%左右,那么在人體血液循環中Sorafenib沒有主要的活性代謝產物。
上述結果與代謝產物M-5的半衰期較長一致。日本癌癥患者在第14天和第28天的數據表明,給藥14天后代謝產物M-5達到穩態。假設Sorafenib及其三種代謝產物(M-2、M-4、M-5)有相似的體外藥理學活性,而且各占人血漿中所有藥物有關物質AUC總量的30%左右,那么在人體血液循環中Sorafenib沒有主要的活性代謝產物。劑量與時間依賴性
劑量依賴性
在I 期單一制劑試驗中,分析了血樣中的Sorafenib及其代謝產物M-2、M-4和M-5。隨著劑量的提高,患者間個體差異相當大,但是Sorafenib在所分析的四種物質(Sorafenib,M-2,M-4和M-5)總量中所占的比例未見明顯變化,表明在100mg bid至800mg bid劑量范圍內,Sorafenib的代謝具有劑量依賴性。
時間依賴性
在幾個臨床試驗中研究了Sorafenib的藥代動力學對時間的依賴性,尤其是試驗10164,評價了給藥后第1、7、21天的全部血藥濃度-時間曲線。這些評價試驗的目的是考察連續給藥時間對Sorafenib及其代謝產物的藥代動力學的影響。試驗發現多劑量給藥連續7天后Sorafenib的 Cmax和AUC值都不再繼續增加。試驗10164中,比較給藥后第7天與第21天的暴露量,發現多劑量給藥后Sorafenib、M-2、M-4的AUC值都不再增加。
代謝產物M-5的形成較慢,因此不可能從第1天起連續檢測M-5的濃度。從給藥后第1天到第7天M-5的暴露量增加,給藥后7天到21天繼續增加,但是給藥后21天到28天的暴露量相近,說明M-5的暴露量在多劑量給藥后21天內達穩態水平。在日本進行的試驗10658中,評價了給藥后第1、14和28天的藥代動力學,發現每日給藥兩次后第14和28天M-5的Cmax和 AUC(0-12)值相近。試驗10658和試驗10164的數據表明,給藥后第7至10天M-5的暴露量達到穩態。代謝產物M-5的形成較慢與其半衰期較長的事實相符。
總之,試驗10164、100277、100283、100342和10658的數據表明,Sorafenib、M-2、M-4和M-5在給藥后14天內均達到藥代動力學穩態水平。
內在因素的影響
評價了Sorafenib的藥代動力學與內在因素的關系,內在因素包括年齡、性別、體重、血清肌酐(以肌酐清除率計)、肝功能(Child-Pugh A級和Child-Pugh B級)以及血清膽紅素等,這一回顧性評價使用了I 期和II 期臨床試驗中Sorafenib治療組患者的數據,這些試驗得到了患者完整的血藥濃度-時間數據。Sorafenib的藥代動力學與年齡、性別、體重、血清肌酐和血清膽紅素沒有明顯的關系。在Child-Pugh A級和B級患者,Sorafenib的系統暴露量和安全性數據相似。比較Sorafenib在日本和高加索患者的藥代動力學,發現Sorafenib在不同患者的暴露量數據在一定程度上重疊。
綜上,根據已得到的400mg bid數據,無需根據年齡、性別、體重(范圍:51至116公斤)調整給藥劑量。
藥物間藥代動力學相互作用
Sorafenib是細胞抑制性抗癌藥物。由于癌癥患者通常需同時使用多種藥物進行治療,所以很有必要研究臨床上Sorafenib與其他藥物的藥代動力學相互作用。通過體外代謝/抑制/誘導及P-gp轉運和抑制數據來表征藥物間潛在的相互作用特性。另外,臨床上評價了某些藥物間的相互作用。抗癌藥物經常和其他抗癌藥聯合使用,所以試驗評價了Sorafenib與其他抗癌藥物的聯合用藥,本文提供了已完成的試驗數據。
大量的體外和體內試驗評價了Sorafenib的代謝特點。Sorafenib的體外代謝試驗確定了I 期和II 期試驗中的代謝途徑,體內試驗研究了Sorafenib對9種人CYP異構體和5種人UDP-葡糖醛酸轉移酶的抑制作用。在人體肝細胞體外試驗中研究了Sorafenib的酶誘導作用。作為體內評價的一部分,在臨床質量平衡試驗和癌癥患者I 期試驗中也研究了Sorafenib的代謝。癌癥患者臨床試驗中考察了Sorafenib對CYP異構體選擇性底物的影響。本部分簡要總結了上述體外和體內代謝試驗的結果。
1)體外代謝數據
體外人肝臟微粒體數據顯示, Sorafenib氧化代謝途徑I主要由CYP3A4催化,而代謝途徑II(與葡糖苷酸結合)主要由UGT1A9催化。代謝產物M-1到M-5是氧化代謝產物,M-6羧酸化代謝產物,M-7和M-8分別是Sorafenib和M-2的葡糖苷酸化產物。
體外試驗評價了Sorafenib甲苯磺酸鹽對9種人CYP異構體的抑制作用。未見Sorafenib對CYP1A2、CYP2A6和CYP2E1活性產生抑制作用;Sorafenib對CYP2C19、CYP2D6和CYP3A4具有中度抑制作用,Ki值分別為17 M、22 M和29 M;CYP2B6、CYP2C8和CYP2C9的活性受到Sorafenib強有力的抑制,Ki值分別為6 M、1~2 M和7~8 M。Sorafenib對代謝途徑II-結合反應催化酶UGT1A1和UGT1A9也具有抑制作用,Ki值為1~2 M。在400mg bid劑量,Sorafenib的穩態血藥濃度Cmax均值為16.6 M(7.7 mg/L)。由于Sorafenib的Cmax值高于文獻報道的多數Ki值,因此Sorafenib可能對這些CYPs底物的體內代謝具有潛在抑制作用。
臨床試驗繼續評價了受到Sorafenib抑制的CYP通道在臨床的相關性。因為Sorafenib通過兩條平行的途徑進行代謝,所以Sorafenib與單一途徑抑制藥物聯合用藥時,暴露量顯著增加的可能性較小。酮康唑臨床抑制試驗結果證實了這一假設,試驗未見明顯的相互作用。同樣,也沒有發現CYP1A2和CYP3A4的誘導作用,說明臨床上發生酶誘導的可能性很小,與試驗10926的結果一致。
2)體外P-糖蛋白(P-gp)抑制數據
Caco-2細胞的通透性評價表明Sorafenib是高滲化合物。Caco-2細胞表達P-gp,Sorafenib從Caco-2細胞底側頂部,再從頂部底側轉運的滲出比為2.9到4.7。假設Sorafenib有高滲透性,預計少量滲出不會影響它在人體的整體吸收。
體外試驗顯示Sorafenib甲苯磺酸鹽對人體P-gp滲出泵具有相當大的抑制作用。抑制探針化合物洛哌丁胺和雙嘧達莫滲出的IC50值分別為0.84µM和1.24µM。在臨床試驗中,在400 mg bid劑量,Sorafenib的血藥濃度高出上述IC50值幾倍之多,所以Sorafenib可能對經P-gp途徑轉運的藥物具有潛在抑制作用。雙嘧達莫與Sorafenib(102)一樣對P-gp具有抑制作用。服用雙嘧達莫不會引起地高辛暴露量顯著增加,因此Sorafenib與P-gp底物聯合用藥時,臨床上可能不會發生明顯的相互作用。與此結論相一致的是有報告指出,P-gp對與藥物吸收有關的相互作用來說可能不太重要。(103)
3)CYP3A抑制劑酮康唑對Sorafenib藥代動力學的影響
體外試驗發現Sorafenib的氧化代謝途徑I主要經由CYP3A4催化。由于很多非生命物質通過CYP3A4進行代謝,許多藥物間的相互作用也與CYP3A4有關,所以我們考察了CYP3A4的強力抑制劑酮康唑對Sorafenib的影響。該試驗中,Sorafenib給藥劑量為50 mg,同時每天服用酮康唑400 mg持續7天。結果表明酮康唑并未增加Sorafenib的暴露量(例如血藥濃度)(表5-8)。
表 5-8:血漿中Sorafenib的 AUC和Cmax參數,以及這些參數在與酮康唑聯用/未與酮康唑聯用時的比值(幾何最小平方均值) (試驗 10927)
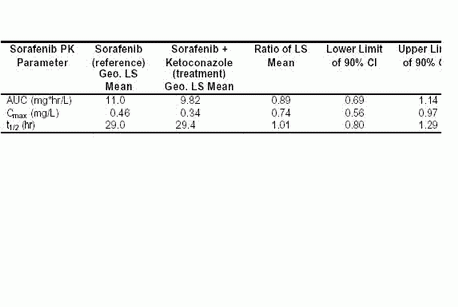 AUC = 血藥濃度-時間曲線下面積
AUC = 血藥濃度-時間曲線下面積CI = 置信區間
Cmax = 最大血藥濃度
PK – 藥代動力學
Geo. LS mean = 幾何最小平方均值
t1/2 = 半衰期,與血藥濃度-時間曲線末端斜率有關。
與酮康唑聯合用藥時,Sorafenib的暴露量未見增加,因此可以推斷經由CYP3A4催化的氧化代謝途徑I在Sorafenib的代謝中不太重要。這些數據結合III期試驗(試驗11213)數據,該試驗中41位Sorafenib治療組患者與19位安慰劑組患者同時服用CYP3A4抑制劑,結果表明臨床上Sorafenib與CYP3A4底物和抑制劑聯合用藥是安全的。
酮康唑是P-gp轉運的強力抑制劑,由于臨床試驗中未見酮康唑對Sorafenib的藥代動力學產生任何影響,所以可推斷P-gp轉運對于血漿中Sorafenib的藥代動力學來說并不重要。
與其他抗癌藥物聯用的相互作用試驗
未見Sorafenib與吉西他濱或奧沙利鉑發生一致的或有意義的藥代動力學相互作用,表明Sorafenib可以與吉西他濱或奧沙利鉑聯合用藥。
Sorafenib與阿霉素聯合用藥,阿霉素在HCC患者的AUC均值增加了21%。尚不清楚這種相互作用是否具有臨床相關性。
Sorafenib與依立替康聯合用藥,依立替康的活性代謝產物SN-38的暴露量顯著增加(67%到120%),SN-38經由UGT1A1進行代謝。這種相互作用的臨床相關性未明。
4)體內評價細胞色素P450對Sorafenib的抑制作用
正在癌癥患者進行的臨床試驗(試驗10926)中,患者長期服用Sorafenib,考察單一CYP異構體抑制作用是否具有臨床相關性,考察了Sorafenib 對CYP2C19(奧美拉唑), CYP2D6(右美沙芬)和CYP3A4 (咪達唑侖)探針底物的影響。
癌癥患者多次服用400 mg bid劑量的Sorafenib后,CYP3A4(咪達唑侖)、CYP2D6 (右美沙芬)和CYP2C19(奧美拉唑)探針底物的藥代動力學均未發生顯著變化。因此臨床上Sorafenib既非CYP2C19、CYP2D6、CYP3A4同工酶的抑制劑,也非它們的誘導劑。Sorafenib不會顯著增加或減少經由這些途徑代謝的化合物的暴露量。
體外試驗中Sorafenib可抑制CYP2C9,Ki值為7-8µM。由于S-華法令主要通過CYP2C9途徑代謝,在試驗11213中,通過PT-INR方法間接檢測Sorafenib對華法令代謝的影響。PT-INR參數在Sorafenib組與安慰劑組未見差異,說明在體內Sorafenib可能并非CYP2C9的抑制劑。
TAG: 多吉美
相關藥品
電子藥歷跟蹤
- 專科病種索引:
- 腫瘤科
- 肝病科
- 神經科
- 精神科
- 皮膚性病科
- 眼科
- 風濕免疫科
- 心腦血管科
- 糖尿病
- 泌尿生殖科
- 營養消化科
- 醫療器械科
- 藥品說明書索引:
- 腫瘤科
- 肝病科
- 神經科
- 精神科
- 皮膚性病科
- 眼科
- 風濕免疫科
- 心腦血管科
- 糖尿病
- 泌尿生殖科
- 營養消化科
- 醫療器械科
- 賽華佗(Savat)手腕式全自動電子血壓計普及型
- MIKI輪椅MP-TI
- 萬安博數字型電子式血壓計HL888HS-J64736臂式
- 傲威足浴盆Z08
- 湯臣倍健R千惠羊胎盤枸杞膠囊
- 新華豐鋁合金腋下拐HF7-07L
- 魚躍輪椅車H032C
- MIKI輪椅車MPTWSW-47JL實心胎
- 潤揚特定電磁波治療儀臺式
- 魚躍腕式電子血壓計YE8800A
- Miki航太鋁合金輪椅MUT-43JD(PU)
- 魚躍電子體溫計
- MiKi輪椅車MCV-49JL實心胎
- 康麥斯牌卵磷脂膠囊
- 盈拓不銹鋼坐廁凳(注塑板)IT701
- 康麥斯牌維生素C片
- 湯臣倍健R維生素C加E咀嚼片
- MiKi輪椅車MPTC-46L實心胎
- 歐姆龍 體重計
- 湯臣倍健R庫拉索蘆薈復合軟膠囊(美國原裝進口)
- 羅氏活力血糖試紙(50片)
- 湯臣倍健R清好清暢膠囊
- MiKi航鈦鋁合金輪椅MPT-47(KL) PU實心胎
- 湯臣倍健R兒童魚肝油軟膠囊
- 魚躍輪椅車H031
- 更多
- 藥品專題索引:
- A
- B
- C
- D
- E
- F
- G
- H
- I
- J
- K
- L
- M
- N
- O
- P
- Q
- R
- S
- T
- U
- V
- W
- X
- Y
- Z
- 暫無記錄
- 暫無記錄
- 暫無記錄
- 暫無記錄
網站資訊- 藥房介紹 |
連鎖門店分布 | 人才招聘 |
聯系我們 | 網站地圖
便民幫助- 常見問題 | 服務指南 | 藥學服務 | 顧客意見 | 顧客投訴 | 專科服務 | 尋醫問藥 | 藥師窗口
專科分類服務- 腫瘤科 | 肝病科 | 神經科 | 精神科 | 皮膚性病科 | 眼 科 | 風濕免疫科 | 心血管科 | 糖尿病科 | 其他科用藥
藥品導購服務- 腫瘤科藥品 | 精神科藥品 | 肝病科藥品 | 眼科藥品 |皮膚性病科藥品 | 神經科藥品 | 風濕免疫科藥品
藥房資質- 企業法人營業執照 | 藥品經營許可證 | 藥品經營質量管理規范認證 | 食品衛生許可證 | 互聯網藥品信息服務資格證
便民幫助- 常見問題 | 服務指南 | 藥學服務 | 顧客意見 | 顧客投訴 | 專科服務 | 尋醫問藥 | 藥師窗口
專科分類服務- 腫瘤科 | 肝病科 | 神經科 | 精神科 | 皮膚性病科 | 眼 科 | 風濕免疫科 | 心血管科 | 糖尿病科 | 其他科用藥
藥品導購服務- 腫瘤科藥品 | 精神科藥品 | 肝病科藥品 | 眼科藥品 |皮膚性病科藥品 | 神經科藥品 | 風濕免疫科藥品
藥房資質- 企業法人營業執照 | 藥品經營許可證 | 藥品經營質量管理規范認證 | 食品衛生許可證 | 互聯網藥品信息服務資格證









