您現在的位置: 百濟新特藥房網首頁 >> 行業資訊 >> 新藥快訊
胃腸道間質瘤精準靶向新藥「阿伐替尼片」上市申請在香港獲受理
- 來源: 百濟藥房藥訊 作者:百濟動態 瀏覽: 發布時間:2021/5/19 17:02:00
2021年5月12日,基石藥業(蘇州)有限公司(以下簡稱“基石藥業”)宣布,公司在香港地區的胃腸道間質瘤(GIST)同類精準靶向藥avapritinib(阿伐替尼)上市申請已獲得受理,該藥物的適應癥為:用于治療攜帶PDGFRA D842V突變無法切除或轉移性胃腸道間質瘤成人患者。
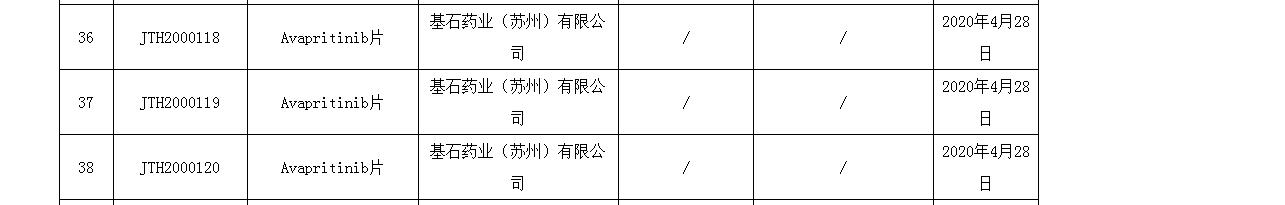
圖片來源:NMPA
Avapritinib是一款KIT和PDGFRA突變激酶抑制劑,由Blueprint Medicines開發,Blueprint Medicines為基石藥業的合作伙伴。
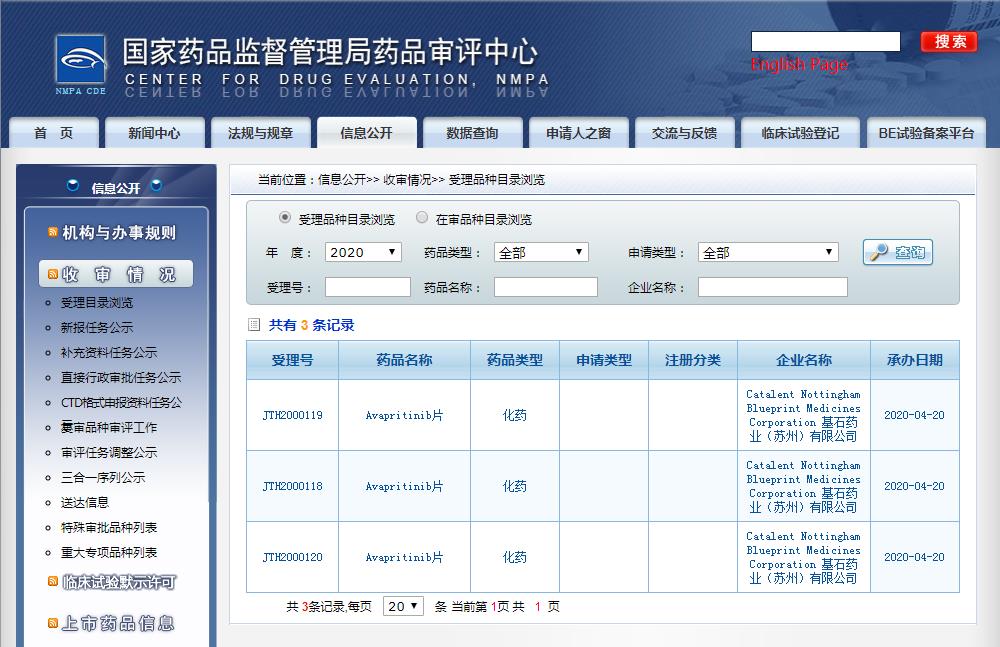
圖片來源:CDE
中國國家藥品監督管理局(NMPA)批準以商品名泰吉華®上市銷售,用于治療攜帶PDGFRA外顯子18突變 (包括PDGFRA D842V突變) 的不可切除性或轉移性GIST成人患者。當前在中國大陸和臺灣地區、美國、歐盟還沒有批準用于其他適應癥,或者其他地區的醫療監管機構還沒有對avapritinib的任何適應癥做出批準決定。
關于胃腸道間質瘤(GIST)
胃腸道間質瘤是發生在胃腸道的肉瘤,肉瘤是發生在骨內或源自結締組織的腫瘤。胃腸道間質瘤起源于胃腸道壁中的細胞,并且常常發生在胃或小腸中。大多數患者的確診年齡在50-80歲之間,胃腸道間質瘤起病比較隱秘,比較容易被常規檢測手段忽略,往往在胃腸道出血、做手術或醫學影像檢查的時候發現,少數在腫瘤破裂或胃腸道發生梗阻后確診,患者往往確診時已屬中晚期階段。
在中國,每年新診斷GIST患者大概有1-1.5/10萬(1.4萬-2.1萬)。原發胃腸道間質瘤中,大概有5%至6%新診斷為胃腸道間質瘤的患者在PDGFRA第18外顯子有突變,較為常見的PDGFRA第18外顯子有突變是PDGFRA D842V突變,這類患者對現有的已批準的KIT藥物不敏感。
許多PDGFRA外顯子18突變的GIST患者更是缺乏治療藥物,臨床上迫切需要新的治療藥物來使這部分患者受到生存獲益。
祝賀avapritinib的新藥上市申請在香港地區獲得受理,期待avapritinib能夠盡快獲批上市,早日惠及更多胃腸道間質瘤患者。








