您現(xiàn)在的位置: 百濟(jì)新特藥房網(wǎng)首頁(yè) >> 藥品專題 >> 多吉美|索拉非尼 >> 臨床研究
多吉美臨床前動(dòng)物毒理學(xué)研究
- 來源: 研究者手冊(cè)第六版 作者:百濟(jì)動(dòng)態(tài) 瀏覽: 發(fā)布時(shí)間:2007/7/30 11:30:00
為考察Sorafenib(甲苯磺酸鹽形式)的毒理學(xué)和毒代動(dòng)力學(xué)性質(zhì),進(jìn)行了全面的非臨床試驗(yàn)研究(表4-6)。考慮到特定的適應(yīng)癥(如癌癥患者),試驗(yàn)設(shè)計(jì)主要側(cè)重于研究幸存者的MTD和發(fā)生不良反應(yīng)的最低水平(LOAEL),其次是確定本品對(duì)所有毒性靶器官的明顯無(wú)效水平。
動(dòng)物試驗(yàn)所選擇的給藥途徑是口服,與人體給藥途徑一致。在大鼠、小鼠和犬進(jìn)行了單劑量毒性/耐受性試驗(yàn)。為給患者長(zhǎng)期用藥提供數(shù)據(jù),重復(fù)用藥毒性試驗(yàn)在大鼠、小鼠和犬進(jìn)行,試驗(yàn)周期在大鼠為每日給藥連續(xù)6個(gè)月,在小鼠為連續(xù)服用3個(gè)月,在犬為12個(gè)月。亞急性毒性試驗(yàn)在大鼠(4周和13周)和犬(4周)進(jìn)行,為考察作用的可逆性和延遲效應(yīng),在治療后繼續(xù)觀察4周。在大鼠和兔進(jìn)行了一系列標(biāo)準(zhǔn)的遺傳毒性試驗(yàn)和胚胎-胎兒發(fā)育毒性試驗(yàn)。
在上述試驗(yàn)計(jì)劃之外,進(jìn)一步補(bǔ)充了試驗(yàn)數(shù)據(jù),因?yàn)殡S著對(duì)Sorafenib研究的深入,一些與毒理學(xué)有關(guān)的問題日益明顯,比如特異性靶器官(骨,牙齒和胰腺),代謝產(chǎn)物和雜質(zhì)的毒理學(xué)性質(zhì)。考慮到本品的臨床應(yīng)用以及目前得到的試驗(yàn)數(shù)據(jù),無(wú)需進(jìn)行某些深入研究,如長(zhǎng)期致癌性試驗(yàn)或生殖毒性試驗(yàn)(生育力和圍產(chǎn)期/出生后試驗(yàn))。為考察人體內(nèi)主要代謝產(chǎn)物M-2(BAY 67-3472)的終末端毒性,單獨(dú)進(jìn)行了M-2的毒理學(xué)試驗(yàn)(在最敏感物種-大鼠進(jìn)行了致突變?cè)囼?yàn)和重復(fù)用藥毒性試驗(yàn))。根據(jù)公司化學(xué)品分類原則,在BAY43-9006(自由堿基)的合成過程中進(jìn)行了常規(guī)職業(yè)安全性和危害評(píng)價(jià);這些試驗(yàn)結(jié)果列在本文中,作為非臨床試驗(yàn)中與安全性有關(guān)的補(bǔ)充資料。
表4-6:Sorafenib的毒理學(xué)試驗(yàn)方案
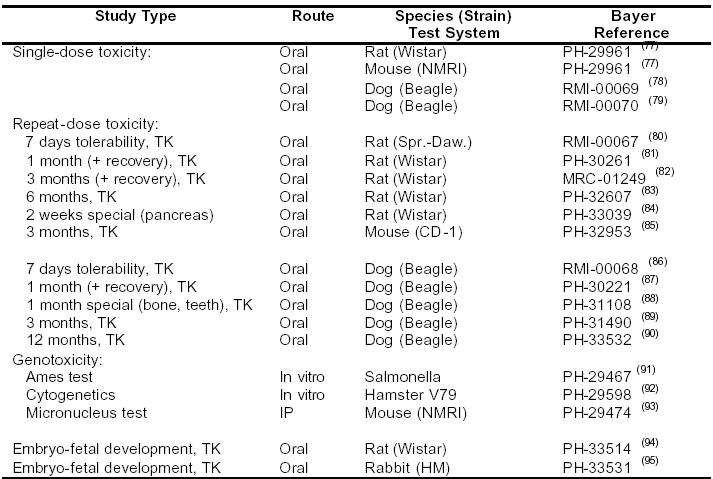
TK:毒代動(dòng)力學(xué)評(píng)價(jià)
IP:腹膜內(nèi)
注:上標(biāo)中的所有數(shù)字參見拜耳內(nèi)部試驗(yàn)報(bào)告
Sorafenib的非臨床安全性資料總結(jié)如下:在多數(shù)應(yīng)用較高劑量的毒理學(xué)試驗(yàn)中,系統(tǒng)暴露量低于隨劑量成比例增加的程度,表明在物種間進(jìn)行比較時(shí),以mg/m2體表面積表示劑量比血藥濃度更為恰當(dāng)。毒理學(xué)響應(yīng)的定性和定量分析在雄性和雌性動(dòng)物間未見顯著差異。在大鼠,小鼠和犬,短期大劑量治療有良好的耐受性。在大鼠和小鼠,依賴于暴露量的發(fā)病率和死亡率(平均死亡時(shí)間≥3周)并未出現(xiàn)上述特征。在犬,胃腸毒性受到劑量的限制。除了在犬發(fā)生的皮膚反應(yīng)和血樣便之外,與毒性有關(guān)的臨床指征十分普通。本品對(duì)CNS機(jī)能并未產(chǎn)生相應(yīng)作用。Sorafenib對(duì)心血管系統(tǒng),尤其是對(duì)心臟復(fù)極化的影響似乎不可能在人發(fā)生在。在動(dòng)物試驗(yàn)中,血液學(xué)和臨床血液化學(xué)常規(guī)參數(shù)的變化并不表示有特異性器官損害發(fā)生。肝毒性的血清標(biāo)志物很明顯,但并未持續(xù)升高。組織病理學(xué)觀察發(fā)現(xiàn),包括肝臟,腎,淋巴網(wǎng)狀結(jié)締/造血系統(tǒng),胃腸道,胰腺,腎上腺,生殖器官,皮膚,牙齒和骨骼在內(nèi)的多個(gè)器官發(fā)生退化和再生現(xiàn)象。以接近或超過致死量的劑量重復(fù)給藥后,大多發(fā)生與毒理學(xué)有關(guān)的損害。發(fā)生顯著損害的閾值劑量隨療程的延長(zhǎng)而降低。大多數(shù)形態(tài)學(xué)損害完全可逆或至少具有好轉(zhuǎn)趨勢(shì)。每日給藥持續(xù)4周或13周后,在為期4周的恢復(fù)期末期仍可觀察到少數(shù)結(jié)構(gòu)性變化(如膽管增生,肝纖維化,以及對(duì)淋巴網(wǎng)狀結(jié)締系統(tǒng)的影響)。在體外和體內(nèi)遺傳毒性試驗(yàn)中,未見任何明顯的遺傳毒性指征。在幼犬進(jìn)行的重復(fù)用藥毒性試驗(yàn)結(jié)果表明,由于對(duì)骨和牙齒的結(jié)構(gòu)、組成產(chǎn)生影響,因此不能排除本品可能對(duì)兒童和青少年具有潛在危害。重復(fù)用藥一般毒性試驗(yàn),胚胎-胎兒發(fā)育試驗(yàn)和組織分布試驗(yàn)結(jié)果表明,本品對(duì)男性和女性的生育力,對(duì)孕期和哺乳期婦女具有潛在危害。
人體內(nèi)主要代謝產(chǎn)物和雜質(zhì)進(jìn)行了獨(dú)立的毒理學(xué)試驗(yàn),結(jié)果表明它們對(duì)整體毒性和評(píng)價(jià)來說不具有特別意義。
|
要點(diǎn):
· 耐受性和MTD隨治療持續(xù)時(shí)間的延長(zhǎng)而降低
· 重復(fù)用藥試驗(yàn)發(fā)現(xiàn),在癌癥患者的推薦劑量:每日兩次,每次400mg范圍內(nèi)或低于此劑量及相應(yīng)的血藥濃度下,多個(gè)器官和組織發(fā)生不良反應(yīng)。
· 某些形態(tài)學(xué)顯著變化并未在臨床上引發(fā)相應(yīng)的癥狀(存活期內(nèi))。
· 根據(jù)在成長(zhǎng)期動(dòng)物進(jìn)行的試驗(yàn),本品對(duì)兒童、青少年的骨骼和牙齒的結(jié)構(gòu)和組成具有潛在危害。
· 重復(fù)用藥一般毒性試驗(yàn),胚胎-胎兒發(fā)育試驗(yàn)以及組織分布試驗(yàn)結(jié)果表明,本品對(duì)男性和女性的生育力,對(duì)孕期和哺乳期婦女具有一定危害。
· 代謝產(chǎn)物并未對(duì)Sorafenib的毒理學(xué)資料產(chǎn)生相應(yīng)影響。
· 藥物中的雜質(zhì)濃度超出安全性范圍時(shí)具有一定的毒性。 |
單劑量毒性
在雄性或雌性大鼠和小鼠,單次口服最高劑量為1460mg/kg的Sorafenib(相當(dāng)于2000mg/kg的甲苯磺酸鹽)后仍能耐受,未見任何毒性指征(77)。在犬,單次口服120mg/kg劑量的Sorafenib溶液劑(相當(dāng)于165mg/kg的甲苯磺酸鹽),以及單次口服1000mg/kg劑量的Sorafenib粉末劑(相當(dāng)于1370mg/kg的甲苯磺酸鹽)均有良好的耐受性;唯一的毒性反應(yīng)是嘔吐(78, 79)。在其他試驗(yàn)中得到的藥代動(dòng)力學(xué)數(shù)據(jù)表明,系統(tǒng)暴露量在較低的口服劑量就能達(dá)到飽和極限。未進(jìn)行非腸道給藥(IV)單劑量毒性試驗(yàn),因?yàn)镾orafenib或Sorafenib甲苯磺酸鹽在IV溶媒中的溶解性很低。
重復(fù)用藥毒性
在大鼠,小鼠和犬進(jìn)行了Sorafenib的重復(fù)用藥毒性試驗(yàn)。最初的試驗(yàn)包括為考察毒理學(xué)終末端而進(jìn)行的,受限的耐受性/藥代動(dòng)力學(xué)試驗(yàn)。
1)嚙齒動(dòng)物
在大鼠每日一次連續(xù)給藥7天,高達(dá)125mg/kg的劑量仍有良好的耐受性(80),短期暴露幾乎未見或未見任何與臨床有關(guān)的毒性指征,盡管在一些器官和組織血液學(xué)、臨床化學(xué)和形態(tài)學(xué)發(fā)生改變。
在大鼠重復(fù)用藥毒性試驗(yàn)中,給藥方式為每日一次口服給藥。在為期3個(gè)月的試驗(yàn)中,在5mg/kg劑量發(fā)生死亡事件(82)。在為期6個(gè)月的長(zhǎng)期毒性試驗(yàn)中(83),在Sorafenib的最高劑量(2.5mg/kg/天)未發(fā)生死亡,因此認(rèn)為此劑量是大鼠長(zhǎng)期用藥的MTD。包括肝,腎,胰腺,淋巴網(wǎng)狀結(jié)締/造血系統(tǒng),胃腸道,腎上腺,牙齒,骨和生殖器官在內(nèi)的多個(gè)組織發(fā)生依賴于劑量的退化和再生現(xiàn)象(程度多為最小到中度)。在大鼠不能全面評(píng)價(jià)恢復(fù)程度,因?yàn)樵诎ǜ邉┝炕謴?fù)組在內(nèi)的兩個(gè)試驗(yàn)中,較早發(fā)生死亡,且死亡率較高。在大鼠經(jīng)3或6個(gè)月的治療后,形態(tài)學(xué)無(wú)效劑量水平低于10mg/kg。在長(zhǎng)期試驗(yàn)中,在最低重復(fù)用藥劑量0.1mg/kg/天,本品對(duì)牙齒具有輕度影響(牙質(zhì)退化),且發(fā)生率較低。血液學(xué)和臨床化學(xué)變化并不表示有器官損害發(fā)生。在大鼠為期6個(gè)月的試驗(yàn)中(83),一系列室外觀察和機(jī)能評(píng)價(jià)均未見任何神經(jīng)毒性指征。在大鼠為期2周的試驗(yàn)中,集中研究了Sorafenib對(duì)胰腺的影響,血清α淀粉酶升高以及胰腺的形態(tài)學(xué)變化表明,胰腺是潛在的毒性靶器官(84)。
在小鼠連續(xù)3月每日服用一次30mg/kg劑量的Sorafenib,臨床上仍能耐受,未見任何與臨床有關(guān)的或組織病理學(xué)嚴(yán)重毒性指征(96)。MTD為100mg/kg/天。在多個(gè)組織可見依賴于劑量的退化/再生現(xiàn)象;主要毒性靶器官似乎是淋巴網(wǎng)狀結(jié)締/造血系統(tǒng),牙齒,肝,腎上腺和胃腸道(胃)。
2)非-嚙齒動(dòng)物
在犬每日一次連續(xù)給藥7天的試驗(yàn)中,口服高達(dá)60mg/kg劑量后有良好的耐受性(86),短期暴露較少或未見任何臨床毒性指征,盡管在一些器官和組織發(fā)生血液學(xué)和臨床化學(xué)參數(shù)改變和形態(tài)學(xué)變化。在犬,每日兩次給予高劑量藥物(總量達(dá)120mg/kg/天)持續(xù)7天,出現(xiàn)難以耐受的明顯指征(嘔吐,腹瀉,震顫和體重減輕)。
隨后在犬進(jìn)行的4周試驗(yàn)中,初始劑量為每日兩次,每次給予10,30或60mg/kg劑量的Sorafenib,30mg/kg bid和60mg/kg bid(每日總劑量分別為:60和120mg/kg)明顯超出MTD水平(87)。嘔吐,血樣便和體重增量減少使得上述給藥劑量難以持續(xù)1周-2周以上;因此在1周后將劑量減少到每日給藥一次。除了對(duì)胃腸道(血樣便)的影響和對(duì)皮膚的明顯作用(脫發(fā)和炎癥)以外,在犬每日1次,每次服用高達(dá)30mg/kg的劑量持續(xù)3或12個(gè)月,臨床上有良好的耐受性(89, 90)。在肝和皮膚觀察到明顯的形態(tài)學(xué)改變。經(jīng)3或12個(gè)月的治療后,形態(tài)學(xué)無(wú)效水平低于10mg/kg/天。在此劑量水平觀察到肝臟(膽管增生)和皮膚(毛囊退化)的某些形態(tài)學(xué)發(fā)生變化。在犬長(zhǎng)期毒性試驗(yàn)所使用的最低劑量水平(3mg/kg/天)仍觀察到輕度皮膚反應(yīng)。組織病理學(xué)觀察發(fā)現(xiàn),在包括腎,淋巴網(wǎng)狀結(jié)締/造血系統(tǒng),胃腸道,腎上腺,牙齒和骨在內(nèi)的多個(gè)組織發(fā)生與劑量有關(guān)的退化和再生現(xiàn)象(多數(shù)為最輕到中度)。在幼犬觀察到本品對(duì)骨(股骨生長(zhǎng)板增厚)和牙齒(牙質(zhì)組成改變)的影響(88)。經(jīng)4周治療后觀察到的一些作用(肝,脾和牙齒),在隨后的4周內(nèi)仍不能完全恢復(fù)(87)。在犬重復(fù)用藥試驗(yàn)中,臨床化學(xué)和血液學(xué)分析發(fā)現(xiàn),這些主要變化表明本品對(duì)肝功能和肝結(jié)構(gòu)產(chǎn)生影響。
遺傳毒性
1)沙門氏菌/微粒體評(píng)價(jià)
Sorafenib的Ames試驗(yàn)為陰性(91)。在生產(chǎn)過程中形成的,同時(shí)也在終產(chǎn)品中出現(xiàn)(<0.15%)的一個(gè)中間產(chǎn)物,Ames試驗(yàn)為陽(yáng)性。
2)體外細(xì)胞遺傳學(xué)試驗(yàn)
體外細(xì)胞遺傳學(xué)試驗(yàn)發(fā)現(xiàn),僅在大鼠肝S9微粒體片段存在時(shí)出現(xiàn)陽(yáng)性結(jié)果(92)。在體外,基因斷裂僅發(fā)生在具有明顯細(xì)胞毒性的濃度。
3)微核試驗(yàn)
致癌性
生殖和發(fā)育毒性
未進(jìn)行特異性生育力試驗(yàn),未進(jìn)行包括母體機(jī)能在內(nèi)的早期胚胎發(fā)育或出生前后(圍產(chǎn)期)發(fā)育試驗(yàn)。在重復(fù)用藥毒性試驗(yàn)中,組織病理學(xué)觀察發(fā)現(xiàn)Sorafenib可通過影響雄性和雌性動(dòng)物的生殖器官而削弱其生育力。在為期1個(gè)月,3個(gè)月和6個(gè)月的毒性試驗(yàn)中,對(duì)生殖器官的多種作用包括:在雄性大鼠,睪丸內(nèi)輸精管退化和附睪精子數(shù)減少;在雌性大鼠,卵巢發(fā)育遲緩和黃體中心性壞死(81-83)。在25mg/kg/天劑量出現(xiàn)明顯的,治療引起的作用。在犬進(jìn)行的為期12個(gè)月的毒性試驗(yàn)中,在30mg/kg/天劑量出現(xiàn)輸精管退化,在60mg/kg/天劑量附睪內(nèi)精子數(shù)減少(90)。
在大鼠(94)和兔(95)進(jìn)行了發(fā)育毒性試驗(yàn)。在大鼠試驗(yàn)中,雌鼠在受精后第6-17天服用0,0.2,1或2.5mg/kg/天劑量的Sorafenib。在2.5mg/kg劑量組發(fā)生明顯的,治療引起的對(duì)子宮發(fā)育的影響,且受孕率降低(晚期再吸收),幸存的受精卵著床后流產(chǎn)率增加(晚期再吸收),從而導(dǎo)致平均產(chǎn)仔量減少,胎盤邊緣壞死和胎盤失血量增加,胎盤和胎兒重量降低。與胎兒體重降低相比,胎兒骨骼骨化遲緩,外觀和臟器畸形(外觀蒼白,無(wú)名動(dòng)脈消失)以及骨骼變異(多余的第14肋骨)的發(fā)生率增加。在2.5mg/kg劑量組,常見的胎兒畸形的發(fā)生也更為頻繁。在1mg/kg劑量組,前蹄,胸骨和胸椎骨的個(gè)別骨骨化遲緩以及食道后主動(dòng)脈弓畸形的發(fā)生不能排除與治療的關(guān)系。在2.5mg/kg/天劑量組觀察到母體機(jī)能數(shù)據(jù)。
在兔試驗(yàn)中,雌兔在受精后第6-第20天服用0,0.3,1或3mg/kg/天劑量的Sorafenib。在3mg/kg劑量組觀察到明顯的母體反應(yīng)。在0.3mg/kg和1mg/kg劑量水平,雌兔耳部可能失去知覺的發(fā)生率增加,而且不能排除這一現(xiàn)象與治療的關(guān)系,該試驗(yàn)未確定母體系統(tǒng)的NOAEL值。在3mg/kg劑量觀察到本品對(duì)胚胎/胎兔發(fā)育的影響,包括再吸收,胎盤部分壞死,著床后后流產(chǎn)率增加,胎兒數(shù)量減少以及性別分布改變,雄性率為40%。在3mg/kg劑量,常見的胎兒畸形(主要是腎,椎骨和肋骨畸形),胸肌融合以及頸椎、前額骨骨化遲緩的發(fā)生率提高,假定這些影響與治療有關(guān)。
局部耐受性
因Sorafenib在人體為口服給藥,未專門進(jìn)行局部耐受性試驗(yàn)。大量的Sorafenib(BAY 43-9006自由堿基)直接用于兔的皮膚和眼睛,未見任何局部刺激或損害(97, 98)。在小鼠皮膚(耳)使用后未發(fā)生任何刺激或過敏反應(yīng)(99)。
其他毒性試驗(yàn)
為表征人體內(nèi)主要代謝產(chǎn)物(M-2,BAY67-3472)的毒理學(xué)性質(zhì),單獨(dú)進(jìn)行了代謝產(chǎn)物試驗(yàn)。M-2的Ames試驗(yàn)為陰性(100)。為研究其系統(tǒng)毒性,在大鼠進(jìn)行了4周試驗(yàn),在Sorafenib的毒理學(xué)試驗(yàn)中,大鼠是最敏感的物種(101)。在試驗(yàn)中,每日給予1、5或25mg/kg劑量的M-2。與相同試驗(yàn)條件下,口服同樣劑量的Sorafenib在4周試驗(yàn)中的結(jié)果相比,代謝產(chǎn)物通常有良好的耐受性,臨床上較少引起病理學(xué)和形態(tài)學(xué)改變。沒有任何跡象表明人體內(nèi)代謝產(chǎn)物M-2比母體化合物Sorafenib毒性更大,實(shí)際上,這一代謝產(chǎn)物的毒性低于Sorafenib。
1)潛在的毒性靶器官
在動(dòng)物觀察到的多個(gè)毒理學(xué)作用可能會(huì)影響在人體進(jìn)行的風(fēng)險(xiǎn)評(píng)估。本部分詳細(xì)討論了這些數(shù)據(jù),尤其是對(duì)肝臟,腎,胃腸道,心血管系統(tǒng),淋巴網(wǎng)狀結(jié)締/造血系統(tǒng),腎上腺,生殖器官,牙齒,骨和皮膚的影響。
肝臟:犬,大鼠和小鼠口服多劑量藥物后,觀察到本品對(duì)肝臟的影響,表現(xiàn)為肝功能參數(shù)變化和形態(tài)學(xué)改變均與劑量有關(guān)。在犬觀察到最顯著的作用。在犬4周試驗(yàn)中,與肝臟有關(guān)的酶的血清水平(特別是丙氨酸轉(zhuǎn)氨酶[ALT],天冬氨酸轉(zhuǎn)氨酶[AST],谷氨酸脫氫酶[GLDH]和堿性磷酸酯酶[ALP])明顯提高(87)。在亞慢性或長(zhǎng)期毒性試驗(yàn)中,較長(zhǎng)時(shí)間的治療后上述標(biāo)記物的血清水平未見明顯改變,且未見任何惡化癥狀。在犬進(jìn)行的所有重復(fù)用藥試驗(yàn)中,觀察到單核細(xì)胞壞死和膽管增生在內(nèi)的組織病理學(xué)變化;在少數(shù)動(dòng)物長(zhǎng)期(12個(gè)月)服藥后發(fā)生肝硬化。用于優(yōu)化系統(tǒng)暴露量的溶媒中含有相對(duì)大量的有機(jī)溶劑,藥物和溶媒的聯(lián)合作用可能會(huì)強(qiáng)化某些肝臟變化。經(jīng)4周治療后,在隨后的4周內(nèi)某些變化,尤其是膽管增生和纖維化未能完全恢復(fù)。在肝臟發(fā)生與毒理學(xué)有關(guān)的不良反應(yīng)的最低劑量(LOAEL)或系統(tǒng)暴露量,在大鼠3個(gè)月試驗(yàn)中是5mg/kg/天(89),在犬12個(gè)月試驗(yàn)中是10mg/kg/天(90)。因?yàn)樵诎┌Y患者,按常規(guī)應(yīng)監(jiān)測(cè)肝功能參數(shù),因此最有可能檢測(cè)到治療引起的任何肝功能改變。
腎:在大鼠進(jìn)行的單劑量藥理學(xué)安全性試驗(yàn)中,觀察到抗利尿劑作用(如排尿量減少達(dá)56%,同時(shí)鈉和氯排出量減少;同樣血液紅細(xì)胞計(jì)數(shù),紅細(xì)胞壓積和Hb總濃度降低)。在300mg/kg的高劑量,這種作用具有統(tǒng)計(jì)學(xué)顯著性;此劑量下的暴露量超出每日兩次每次服用400mg Sorafenib 后在人體的暴露量。在重復(fù)用藥毒性試驗(yàn)中,組織切片在顯微鏡下可見腎病指征。有時(shí)尿樣分析發(fā)現(xiàn)本品對(duì)腎臟的影響,但血清中腎功能改變的標(biāo)志物卻不顯著。經(jīng)4周治療后,在隨后的4周內(nèi)一些形態(tài)學(xué)變化(在大鼠4周試驗(yàn)中,在超出MTD的劑量,描述為嗜堿性腎小管管狀膨脹)并未完全恢復(fù)。這些變化表明在大鼠,僅在接近或超出MTD的劑量對(duì)腎功能的影響較為突出。引起與毒理學(xué)有關(guān)的形態(tài)學(xué)變化的LOAEL,在大鼠6個(gè)月試驗(yàn)中是1mg/kg/天(83),在犬12個(gè)月試驗(yàn)中是10mg/kg/天(90)。因?yàn)樵诎┌Y患者,按常規(guī)應(yīng)監(jiān)測(cè)腎毒性標(biāo)記物,因此有可能檢測(cè)到任何與治療有關(guān)的腎功能變化。
包括外分泌胰腺在內(nèi)的胃腸道:犬單次服用大劑量藥物后出現(xiàn)嘔吐。在犬重復(fù)用藥試驗(yàn)中,胃腸道(嘔吐,血樣便)反應(yīng)似乎受到劑量的限制。在小鼠3個(gè)月試驗(yàn)中(85),口服30,100或300mg/kg/天劑量后,胃部出現(xiàn)治療引起的明顯改變,包括與劑量有關(guān)的彌漫性增生和角化過度。為得到完整的毒理學(xué)資料,大劑量藥物溶于含有有機(jī)溶劑的大量溶媒中口服給藥,因此本品對(duì)胃粘膜的刺激可能屬于局部作用,而非系統(tǒng)反應(yīng)。在重復(fù)用藥試驗(yàn)中,組織病理學(xué)觀察大鼠和犬的腸道,可見輕度退化和再生性改變。在接受Sorafenib治療的癌癥患者,同樣發(fā)生胃腸不耐受性。
在大鼠和小鼠重復(fù)用藥試驗(yàn)中,發(fā)現(xiàn)外分泌胰腺的形態(tài)學(xué)發(fā)生變化,在Sorafenib的臨床試驗(yàn)中血清淀粉酶和脂肪酶水平升高。在大鼠重復(fù)用藥試驗(yàn)中(84),以強(qiáng)飼法連續(xù)2周每日給予5或25mg/kg劑量的Sorafenib,專門研究了本品對(duì)這些參數(shù)可能存在的影響。結(jié)果表明Sorafenib對(duì)大鼠的外分泌胰腺具有中度作用,血清α-淀粉酶水平出現(xiàn)瞬時(shí)升高。在大鼠每日口服給藥,療程在2周以上的毒性試驗(yàn)中,胰腺形態(tài)學(xué)在高于MTD劑量發(fā)生明顯改變;每日口服低于或等于MTD劑量的Sorafenib,連續(xù)治療1,3或6個(gè)月后,顯微鏡下觀察未見任何一致性變化(81-83)。因?yàn)樵谂R床設(shè)計(jì)中需監(jiān)測(cè)本品對(duì)外分泌胰腺的影響,所以本品對(duì)人體的作用不具有顯著意義。
心血管系統(tǒng),心臟安全性非臨床評(píng)價(jià)(QT間隔):在體外藥理學(xué)安全性試驗(yàn)中,進(jìn)行hERG檢測(cè)時(shí)出現(xiàn)的信號(hào)表明本品對(duì)心電圖QT間隔具有潛在影響。但是在動(dòng)物,包括其物理學(xué)模型與人體相關(guān)的犬體內(nèi)試驗(yàn)中,根據(jù)心電圖記錄,臨床病理學(xué)或組織病理學(xué)觀察所見,未發(fā)現(xiàn)任何心血管毒性指征。根據(jù)上述試驗(yàn)結(jié)果,Sorafenib對(duì)心血管系統(tǒng),尤其是對(duì)心臟復(fù)極化的影響似乎不可能在人體發(fā)生。
淋巴網(wǎng)狀結(jié)締/造血系統(tǒng):在重復(fù)用藥毒性試驗(yàn)中,血液學(xué)和組織病理學(xué)觀察未見任何淋巴網(wǎng)狀結(jié)締/造血系統(tǒng)毒性指征。在相對(duì)較低的劑量水平,觀察到骨髓,胸腺和脾臟的形態(tài)學(xué)發(fā)生變化,以及本品對(duì)白細(xì)胞,紅細(xì)胞參數(shù)和凝血功能產(chǎn)生影響。在等于或高于MTD劑量,上述作用為輕到中度。這一現(xiàn)象與細(xì)胞毒類抗腫瘤藥物治療后產(chǎn)生的作用正好相反。
腎上腺:大鼠,小鼠和犬服用接近或超過MTD劑量,重復(fù)用藥后發(fā)現(xiàn)腎上腺形態(tài)學(xué)發(fā)生變化,包括出血和壞疽現(xiàn)象,最可能的原因是受影響的動(dòng)物健康條件較差。
生殖系統(tǒng):重復(fù)用藥毒性試驗(yàn)結(jié)果表明,Sorafenib能削弱動(dòng)物的繁殖能力和生育力,并對(duì)雄性和雌性動(dòng)物的生殖器官產(chǎn)生各種不同作用,其中大鼠比小鼠或犬更為敏感。在大鼠為期4周的試驗(yàn)中,典型作用包括睪丸,附睪,前列腺和精囊退化以及發(fā)育遲緩(在25mg/kg/天劑量較為明顯和顯著,臨界作用始于1mg/kg/天)(81)。在大鼠3個(gè)月試驗(yàn)中(82),在雌鼠發(fā)生黃體中心性壞死和卵巢發(fā)育不良(LOAEL為5mg/kg/天)。在犬12個(gè)月試驗(yàn)中(90),在30mg/kg/天劑量出現(xiàn)輸精管退化,在60mg/kg/天劑量精子數(shù)減少。大鼠(94)和兔(95)發(fā)育毒性試驗(yàn)表明Sorafenib具有明顯的胎兒毒性(著床后流產(chǎn),再吸收,骨骼發(fā)育遲緩,胎兒體重增量緩慢)。此外,本品還具有潛在的致畸性(常見的,分布廣泛的畸形,以及某一外觀和內(nèi)臟畸形)。這些作用發(fā)生在遠(yuǎn)遠(yuǎn)低于人用臨床治療劑量的水平(大鼠的LOAEL為1mg/kg/天,兔為3mg/kg/天)。在哺乳期大鼠進(jìn)行的組織分布試驗(yàn)中,乳汁中含有高濃度的Sorafenib及其代謝產(chǎn)物(乳汁/血漿水平之比約為5)。因?yàn)樵趧?dòng)物試驗(yàn)中觀察到生殖毒性,Sorafenib不宜用于孕期婦女。建議患者在治療時(shí)應(yīng)采取措施避免受孕,建議哺乳期婦女在服用Sorafenib時(shí)不宜母乳喂養(yǎng)。
骨,牙齒:幼犬多次服用本品后,骨和牙齒的發(fā)育發(fā)生多種變化,包括股骨生長(zhǎng)板不規(guī)則增厚(LOAEL為30mg/kg/天),此生長(zhǎng)板附近骨髓細(xì)胞減少(LOAEL為10 mg/kg/天),以及牙質(zhì)組分改變(LOAEL為30 mg/kg/天)。因?yàn)樵囼?yàn)中使用的是幼年和發(fā)育期動(dòng)物,另外在老年犬進(jìn)行了試驗(yàn),評(píng)價(jià)本品對(duì)不同發(fā)育階段的作用(88)。成年犬連續(xù)4周內(nèi)每日服用60 mg/kg劑量的Sorafenib。與以前在幼犬進(jìn)行的試驗(yàn)相比,在成年犬未見股骨或牙齒形態(tài)學(xué)發(fā)生與治療有關(guān)的改變。在大鼠和小鼠,觀察到本品對(duì)牙齒的明顯作用,包括牙質(zhì)組分改變。在嚙齒動(dòng)物得到的數(shù)據(jù)很難外推到人,因?yàn)榕c人類相反,小鼠和大鼠的牙齒,特別是門牙終生都在生長(zhǎng)。但是,可以得出結(jié)論:本品對(duì)兒童或青少年的骨骼和牙齒具有潛在危害。
皮膚:在犬重復(fù)用藥試驗(yàn)中,在開始服藥后的第4-8周,皮膚開始出現(xiàn)明顯損害,并伴有脫發(fā)和炎癥。在犬12個(gè)月毒性試驗(yàn)(90)中,在10mg/kg/天劑量出現(xiàn)輕度脫發(fā),而在30或60mg/kg/天劑量頭發(fā)幾乎完全脫落,脫發(fā)還伴有軀干和腋窩部位皮膚發(fā)紅。在出現(xiàn)明顯反應(yīng)的動(dòng)物,顯微鏡下觀察其皮膚斷面,可見皮炎和毛囊萎縮/退化,常伴有外周毛囊炎,偶有棘皮癥。在犬12個(gè)月試驗(yàn)中發(fā)生意外死亡事件,原因可能是皮膚的正常保護(hù)功能受到干擾,從而間接引起全身性感染。在服用3mg/kg/天劑量Sorafenib的雄性犬,也觀察到極輕微的皮炎和輕度禿頭癥/毛囊退化。在大鼠或小鼠未見類似變化。尚不清楚在犬觀察到的皮膚反應(yīng)與人體數(shù)據(jù)是否具有相關(guān)性(如手-足皮膚反應(yīng))。
在動(dòng)物重復(fù)用藥試驗(yàn)中,毒理學(xué)主要終末端,以及能引起毒理學(xué)有關(guān)作用的(如LOAEL),以mg/kg/天和mg/m2/天表示的最低劑量數(shù)據(jù)匯總在表4-7。相應(yīng)的穩(wěn)態(tài)血藥濃度(AUC)列在表4-8。因?yàn)镾orafenib與血漿蛋白高度結(jié)合,且與物種有關(guān)(未結(jié)合部分:小鼠和大鼠為0.5%,犬0.9%,人0.5%),血藥濃度總量以及未結(jié)合部分濃度均列在表中。
比較各動(dòng)物在重復(fù)用藥毒性試驗(yàn)中的數(shù)據(jù)發(fā)現(xiàn),小鼠對(duì)于所有毒理學(xué)終點(diǎn)最不敏感。對(duì)于死亡率和其他多數(shù)毒理學(xué)參數(shù),大鼠比犬更為敏感。長(zhǎng)時(shí)間服用接近或超過致死量的藥物后觀察到很多反應(yīng),因此至少可以部分歸因于動(dòng)物的身體狀況較差。一些數(shù)據(jù)對(duì)于某一物種來說更為顯著或具有特異性。例如,對(duì)皮膚的作用僅在犬發(fā)生;血液學(xué)作用以及對(duì)生殖器官的損害在大鼠更為突出;與其他物種相比,在較低的系統(tǒng)暴露量,本品對(duì)犬肝臟的作用較為廣泛。
在臨床試驗(yàn)中,癌癥患者連續(xù)每日口服400mg bid劑量的Sorafenib(對(duì)于60kg體重的患者,相當(dāng)于13.3mg/kg/天或500mg/m2/天)后,Sorafenib的總血藥濃度均值約為130mg.h/L(AUC0-24h),穩(wěn)態(tài)Cmax約為7.7mg/L。在人體服用400mg bid劑量的Sorafenib后,血漿中Sorafenib未結(jié)合部分的濃度以AUC0-24h,未結(jié)合計(jì)約為0.65 mg.h/L。在動(dòng)物亞慢性或長(zhǎng)期毒性試驗(yàn)中,能觀察到顯著毒性的劑量水平以及Sorafenib相應(yīng)的血藥濃度均低于癌癥患者服用推薦劑量400mg bid后的水平。
表4-7:Sorafenib:在動(dòng)物每日給藥,至少持續(xù)4周的重復(fù)用藥毒性試驗(yàn)中,觀察到不良反應(yīng)的最低水平(LOAEL)
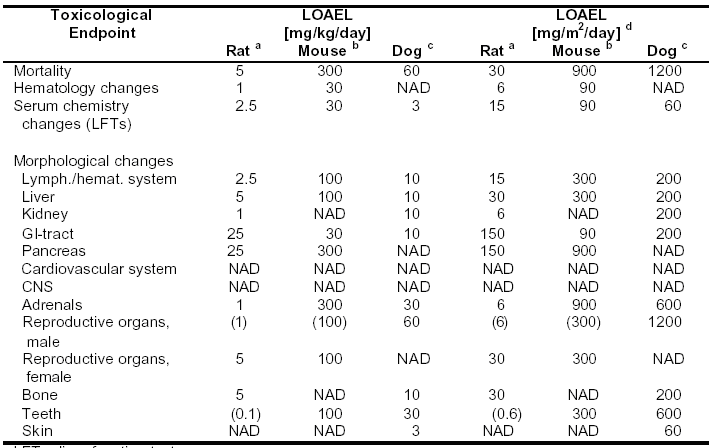
LFT=肝功能檢查
LOAEL=能觀察到不良反應(yīng)的最低水平
NAD=在考察的最高劑量,未見與毒理學(xué)有關(guān)的異常現(xiàn)象
() 臨界效應(yīng),發(fā)生率和/或嚴(yán)重程度較低
a 劑量范圍:0.1,1,2.5,5,25,125 mg/kg/天
b 劑量范圍:30,100,300 mg/kg/天
c 劑量范圍:3,10,30,60mg/kg/天
d 小鼠:1mg/kg=3mg/m2;大鼠:1mg/kg=6mg/m2;犬:1mg/kg=20mg/m2;
表4-8:在動(dòng)物每日給藥,至少持續(xù)4周的重復(fù)用藥毒性試驗(yàn)中,在能觀察到不良反應(yīng)的最低劑量水平(LOAEL),血漿中Sorafenib的總暴露量和未結(jié)合部分暴露量
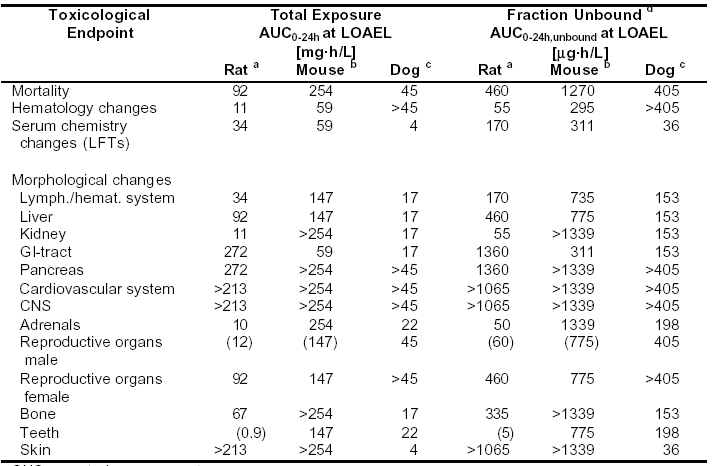 CNS=中樞神經(jīng)系統(tǒng)
CNS=中樞神經(jīng)系統(tǒng)GI=胃腸
LFT=肝功能檢查
LOAEL=能觀察到不良反應(yīng)的最低水平
> 在考察的最高劑量,未見與毒理學(xué)有關(guān)的異常現(xiàn)象
() 臨界效應(yīng),發(fā)生率和/或嚴(yán)重程度較低
a 劑量范圍:0.1,1,2.5,5,25,125 mg/kg/天;暴露量數(shù)據(jù)來源于4周和6周試驗(yàn),在雄性與雌性動(dòng)物取均值
b 劑量范圍:30,100,300 mg/kg/天
c 劑量范圍:3,10,30,60mg/kg/天;暴露量數(shù)據(jù)來源于12個(gè)月試驗(yàn),在雄性與雌性動(dòng)物取均值
討論和結(jié)論
Sorafenib的非臨床安全性數(shù)據(jù)總結(jié)如下:
· 在多數(shù)應(yīng)用高劑量的毒性試驗(yàn)中,系統(tǒng)暴露量低于隨劑量成比例增長(zhǎng)的水平,表明在各物種間進(jìn)行比較時(shí),以mg/m2體表面積來表示劑量可能比血藥濃度更為合適。
· 對(duì)雄性和雌性動(dòng)物的毒理學(xué)響應(yīng)進(jìn)行定性或定量分析,二者未見重要差異。
· 在大鼠,小鼠和犬,短期高劑量治療在臨床上有良好的耐受性。
· 與暴露量有關(guān)的發(fā)病率和死亡率(平均死亡時(shí)間≥3周)在大鼠和小鼠未見之前所述的物種間差異。在犬,胃腸毒性受到劑量的限制,除了皮膚反應(yīng)和血樣便之外,毒性臨床指征并不明顯。
· 未見本品對(duì)CNS功能產(chǎn)生相應(yīng)作用。
· Sorafenib對(duì)心血管系統(tǒng),尤其是對(duì)心臟復(fù)極化的影響似乎不可能在人體發(fā)生。
· 在動(dòng)物試驗(yàn)中,血液學(xué)和血液臨床化學(xué)常規(guī)參數(shù)的改變并非總是代表發(fā)生特異性器官損害。肝毒性標(biāo)記物在血清中十分明顯,但并未持續(xù)升高。
· 組織病理學(xué)觀察發(fā)現(xiàn),包括肝,腎,淋巴網(wǎng)狀結(jié)締/造血系統(tǒng),胃腸道,胰腺,腎上腺,生殖器官,皮膚,牙齒和骨在內(nèi)的多個(gè)器官系統(tǒng)發(fā)生退化和再生現(xiàn)象。在重復(fù)用藥試驗(yàn)中,與毒理學(xué)有關(guān)的損害多數(shù)發(fā)生在接近或超過致死量的劑量水平。發(fā)生顯著損害的閾劑量隨暴露時(shí)間的延長(zhǎng)而下降。大多數(shù)形態(tài)學(xué)損害完全可逆或至少趨向于恢復(fù)。在恢復(fù)期結(jié)束時(shí),僅可見少數(shù)結(jié)構(gòu)變化(如膽管增生,肝纖維化和對(duì)淋巴網(wǎng)狀結(jié)締組織的影響)。
· 在體外和體內(nèi)遺傳毒性試驗(yàn)中未見任何遺傳毒性指征。
· 根據(jù)幼犬重復(fù)用藥毒性試驗(yàn)結(jié)果,因本品可影響骨和牙齒的結(jié)構(gòu)及組成,因此不能排除本品對(duì)兒童和青少年具有潛在危害。
· 重復(fù)用藥一般毒性試驗(yàn),胚胎-胎兒發(fā)育試驗(yàn)和組織分布試驗(yàn)結(jié)果表明,在人體,本品對(duì)生育以及孕期和哺乳期婦女具有一定危害。
在單獨(dú)進(jìn)行的毒理學(xué)試驗(yàn)中,人體內(nèi)主要代謝產(chǎn)物和雜質(zhì)對(duì)于整體毒理學(xué)資料來說無(wú)關(guān)緊要。
在動(dòng)物亞慢性或長(zhǎng)期服用Sorafenib(及相應(yīng)的血藥濃度)試驗(yàn)中觀察到的多數(shù)毒性反應(yīng),與癌癥患者服用推薦劑量每日兩次,每次400mg后的結(jié)果相似。因此不能排除患者服用本品后的風(fēng)險(xiǎn)性;但是1300例以上的患者已經(jīng)服用Sorafenib單一制劑,而且多數(shù)患者長(zhǎng)期服用Sorafenib是安全的。
TAG:多吉美
相關(guān)藥品
網(wǎng)站資訊- 藥房介紹 |
連鎖門店分布 | 人才招聘 |
聯(lián)系我們 | 網(wǎng)站地圖
便民幫助- 常見問題 | 服務(wù)指南 | 藥學(xué)服務(wù) | 顧客意見 | 顧客投訴 | 專科服務(wù) | 尋醫(yī)問藥 | 藥師窗口
專科分類服務(wù)- 腫瘤科 | 肝病科 | 神經(jīng)科 | 精神科 | 皮膚性病科 | 眼 科 | 風(fēng)濕免疫科 | 心血管科 | 糖尿病科 | 其他科用藥
藥品服務(wù)- 腫瘤科藥品 | 精神科藥品 | 肝病科藥品 | 眼科藥品 |皮膚性病科藥品 | 神經(jīng)科藥品 | 風(fēng)濕免疫科藥品
百濟(jì)藥房資質(zhì)- 企業(yè)法人營(yíng)業(yè)執(zhí)照 | 互聯(lián)網(wǎng)藥品信息服務(wù)資格證
便民幫助- 常見問題 | 服務(wù)指南 | 藥學(xué)服務(wù) | 顧客意見 | 顧客投訴 | 專科服務(wù) | 尋醫(yī)問藥 | 藥師窗口
專科分類服務(wù)- 腫瘤科 | 肝病科 | 神經(jīng)科 | 精神科 | 皮膚性病科 | 眼 科 | 風(fēng)濕免疫科 | 心血管科 | 糖尿病科 | 其他科用藥
藥品服務(wù)- 腫瘤科藥品 | 精神科藥品 | 肝病科藥品 | 眼科藥品 |皮膚性病科藥品 | 神經(jīng)科藥品 | 風(fēng)濕免疫科藥品
百濟(jì)藥房資質(zhì)- 企業(yè)法人營(yíng)業(yè)執(zhí)照 | 互聯(lián)網(wǎng)藥品信息服務(wù)資格證